綜合新聞
陳聰博士等在《Emerging Microbes & Infections》雜志發表解析結核桿菌甘氨酰胺-核糖核酸酶-甲酰化酶T (MtbPurT)結構的研究論文
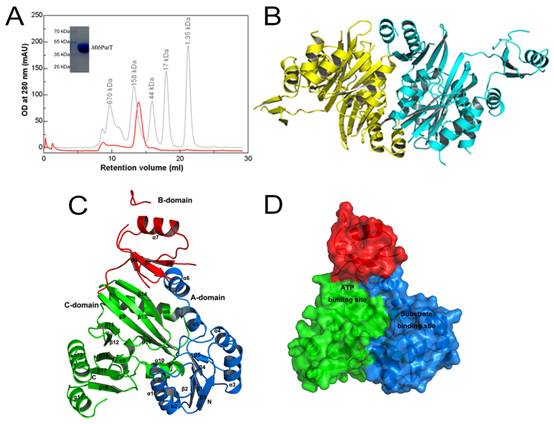
基于世界衛生組織在全球范圍內進行的多重耐藥結核菌(MDR-TB)感染的總體評估結果,多重耐藥結核菌正在全球迅速蔓延,而中國是多重耐藥結核菌感染的高發國家,抗結核新藥的研發十分緊迫。核苷代謝途徑是結核桿菌能量代謝的重要來源,其中關鍵的酶則被認為是新藥研發的重要靶標。本研究成功解析了嘌呤補救合成代謝途徑中的甘氨酰胺-核糖核酸酶-甲酰化酶T (glycinamide-RNasetransformylase T, PurT)的晶體結構(2.79 Å分辨率)。研究發現,與霍氏熱球菌PurT(phBCCPPurT)相比,MtbPurT呈現出更加“開放”構象,有助于輔助因子的進出。此外,MtbPurT活性位點與大腸桿菌PurT(EcPurT)中ATP結合位點表現出較高的結構相似性,但其GAR底物結合位點具有顯著差異。特別是MtbPurT中的383-389環更短,與底物GAR的磷酸基團相距5.7Å。不同的GAR結合模式導致MtbPurT的構象發生較大變化,為抗結核桿菌藥物的開發提供潛在的機會。